LAS MOSQUITOS TRANSMISORES DE ENFERMEDADES AUMENTAN POR LA ACTIVIDAD HUMANA
Los seres humanos alteran el medio ambiente a un ritmo sin precedentes mediante la destrucción del hábitat, la contaminación de nutrientes y la aplicación de agroquímicos. Recientemente, se ha propuesto que esto actúa como un impulsor potencialmente significativo de especies de mosquitos portadores de patógenos (vectores de enfermedades) que representan un riesgo para la salud de los seres humanos y el ganado.
Aquí, utilizamos un conjunto único de ubicaciones a lo largo de un gran gradiente geográfico para mostrar que los paisajes perturbados por una variedad de estresores antropogénicos se asocian consistentemente con comunidades de mosquitos dominadas por vectores para una amplia gama de infecciones humanas y ganaderas. Esto sugiere fuertemente que las alteraciones humanas al medio ambiente promueven la presencia y abundancia de vectores de enfermedades en grandes extensiones espaciales. Como tal, justifica más estudios dirigidos a desentrañar los mecanismos subyacentes a la prevalencia de vectores en las comunidades de mosquitos y abre nuevas oportunidades para la acción preventiva y la modelización predictiva de los riesgos de enfermedades transmitidas por vectores en relación con la degradación de los ecosistemas naturales.
Introducción
La destrucción del hábitat, la contaminación química y el cambio climático son perturbaciones humanas continuas 1 que han provocado cambios a nivel mundial en las comunidades de insectos 2. Si bien la mayoría de los insectos están disminuyendo 2, muchas especies de mosquitos prosperan 3, 4. Estudios recientes de laboratorio y mesocosmos proporcionaron pistas importantes que sugieren que las perturbaciones antropogénicas pueden promover el crecimiento de la población de varias especies de mosquitos transmisores de patógenos o vectores de enfermedades 5, 6, 7, 8, y potencialmente mediar interacciones entre especies de mosquitos 9, sus huéspedes 10, sus patógenos 11, 12, y sus depredadores 13. Esto sugiere que, si estos patrones son válidos para los sistemas naturales, la forma en que los humanos influyen en su entorno local presenta un factor crítico de riesgo de enfermedad 14.
Los datos de campo en los sistemas naturales se han centrado en gran medida en la influencia del clima (temperatura y precipitación) en el impulso de la abundancia de especies individuales o grupos de vectores 15, 16, 17, 18, 19. Estos estudios constituyen una base importante para modelos mecanicistas y mapas de riesgo para anticipar brotes de enfermedades como malaria, chikungunya y Zika 20, 21. La abundancia y composición de los mosquitos también puede variar según la ubicación y el tipo de uso de la tierra 22, 23, 24, 25, 26, 27. Sin embargo, muchas comparaciones se basan en el muestreo oportunista en diferentes períodos de tiempo o en el muestreo dirigido en ubicaciones para maximizar las colecciones28, pero no siempre 29, 30. Aquí, utilizamos un diseño de muestreo emparejado para mostrar que las actividades humanas más allá del clima están fuertemente asociadas con una gran abundancia de vectores conocidos en grandes extensiones espaciales.
El Parque Nacional Kruger (KNP) es la reserva natural más grande de Sudáfrica y está bordeada por áreas rurales y urbanizadas. El mosaico de masas de agua a lo largo de su gradiente norte-sur de 400 km brinda una oportunidad única para evaluar el efecto de las perturbaciones humanas en la dinámica de la población de mosquitos y la composición de la comunidad. Simultáneamente, tomamos muestras de cuerpos de agua representativos en sitios pareados dentro y fuera del parque nacional en cuatro regiones (Fig. 1); los sitios emparejados tienen condiciones geomorfológicas y climáticas similares (Tabla S1, Figura S1) pero difieren en cómo se ven afectados por los seres humanos. Para obtener una evaluación general de la perturbación antropogénica, cuantificamos 5 presiones antropogénicas ubicuas 1: (1) abundancia de plaguicidas organofosforados, (2) eutrofización, (3) densidad de población humana, (4) biomasa ungulada y (5) pérdida de vegetación, en cada uno de las ubicaciones emparejadas, todas las cuales se ha demostrado por separado para influir en las poblaciones de mosquitos 5, 6, 10, 24.
Figura 1
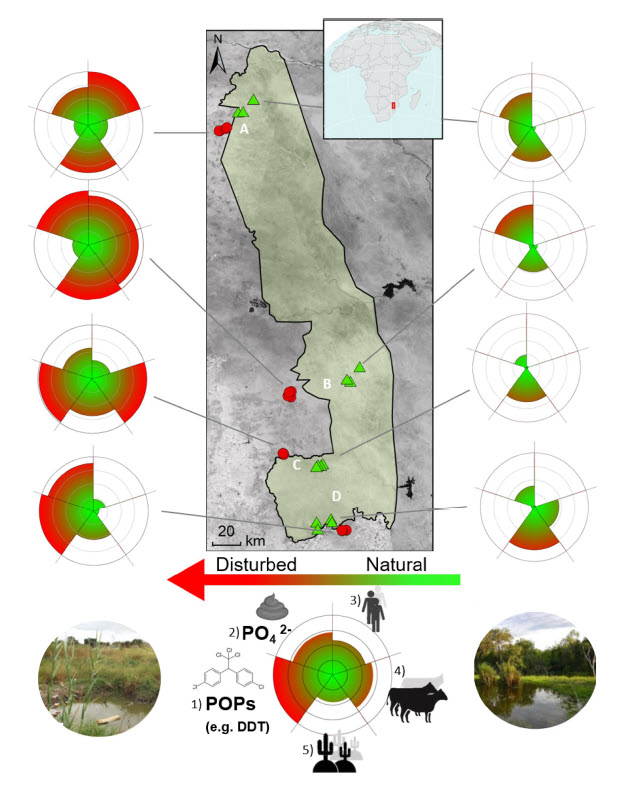
Variación en las presiones antropogénicas comparando cuerpos de agua adentro (triángulos verdes) y afuera KNP (símbolos rojos). Cada gráfico de radar representa cinco presiones; la intensidad va de baja (verde) a alta (rojo) y fue reescalada dividiendo por el máximo: (1) concentraciones de plaguicidas (COP); (2) eutrofización acuática; (3) densidad de población humana; (4) biomasa de ungulados; (5) porcentaje de área desnuda o con poca vegetación. A – D se refieren a las diferentes regiones: Punda Maria (A), Satara (B), Skukuza (C) y Malelane (D). Los mapas se construyeron en ArcGIS 10.5. Fotos: Maarten Schrama.
Resultados y discusión
Las cinco presiones fueron consistentemente más altas en el exterior que en el interior de KNP: (1) la concentración media de organofosforados fue 196,1 en el exterior frente a 3,5 µg kg − 1 en el interior (F (1,15) = 9,12; p <0,01); (2) la eutrofización medida como la concentración media de fosfato disuelto fue 0,91 en el exterior frente a 0,60 mg P L − 1 en el interior (F (1,31) = 4,6; p = 0,04); (3) la densidad de población humana fue de 844 fuera frente a 0,06 indiv. km − 2 dentro (F (1,6) = 307,3; p <0,01); (4) la biomasa del ganado ungulado fue de 1.186 en el exterior frente a 321 kg km − 2 en el interior (F (1,31) = 10,7; p <0,01); (5) el porcentaje de cobertura de suelo desnudo y con poca vegetación fue del 62% en el exterior frente al 42% en el interior de KNP (F (1,31) = 6,38; p = 0,02). La magnitud de estas diferencias varió entre regiones (Tabla S2). Estas presiones generan una medida compuesta de perturbación (Fig. 1) y confirman que los cuerpos de agua fuera de KNP son constantemente más afectados por las presiones antropogénicas.
Para cuantificar si estos niveles más altos de perturbación están relacionados con cambios en las comunidades de mosquitos, atrapamos 3.918 hembras de 39 especies de mosquitos y complejos de especies (Diptera: Culicidae). El diseño de trampas emparejadas (Fig. 1) nos permitió recolectar mosquitos simultáneamente de los cuerpos de agua dentro y fuera de KNP 31. La abundancia de mosquitos fuera del parque nacional fue en promedio 2.9 veces mayor (rango: 1.5-10 veces mayor) que dentro de KNP (F (1,24) = 17.3, p <0.001; Fig. 2A – D). Este patrón se asemeja a la abundancia de mosquitos a lo largo de gradientes de perturbación humana en el Mediterráneo 24 y las selvas tropicales de Tailandia 29. Más importante aún, observamos cambios pronunciados en la composición de especies de mosquitos dentro y fuera de KNP (ANOSIM: r = 0.15; p <0.001) para cada una de las cuatro regiones geográficas (Fig. 2A-D, Tabla S3). A pesar de las diferencias en la riqueza general (35 especies fuera frente a 30 dentro de KNP) y las diferencias mencionadas anteriormente en la composición de especies, no observamos diferencias entre las diferentes métricas de diversidad alfa dentro y fuera de KNP (riqueza de especies, J de Shannon, H'max de Shannon y uniformidad de Simpson; Figuras S2A-C). Los vectores conocidos de enfermedades humanas y del ganado eran más abundantes fuera que dentro de KNP; estas especies explicaron el 79% (± DE 3) de la variación en las comunidades entre regiones emparejadas (Fig. 2E; SIMPER: r = 0,48; p <0,001). Este patrón fue consistente para cada una de las regiones (Malelane 82%, Satara 78%, Punda Maria 76%, Skukuza 77%; Figuras S3A-D, S4). También fue en gran parte consistente entre los vectores y las infecciones: Aedes aegypti, un vector del dengue, chikungunya, fiebre amarilla y Zika 32, era más común fuera de KNP. Varias especies de Culex también fueron más comunes en el exterior, incluidos los vectores del Nilo Occidental, sindbis, Wesselsbron y filariasis (Fig. 2E-F). Solo dos especies de vectores, Ae. vexans y Cx. theileri, vectores de la fiebre del Valle del Rift 32, eran más abundantes dentro de KNP. Estos patrones están en consonancia con los estudios realizados a lo largo de gradientes de deforestación, que se ha demostrado que conducen a una mayor presencia de vectores de la malaria como An. gambiae y An. Darlingi 18, 33, 34, 35.
Figura 2
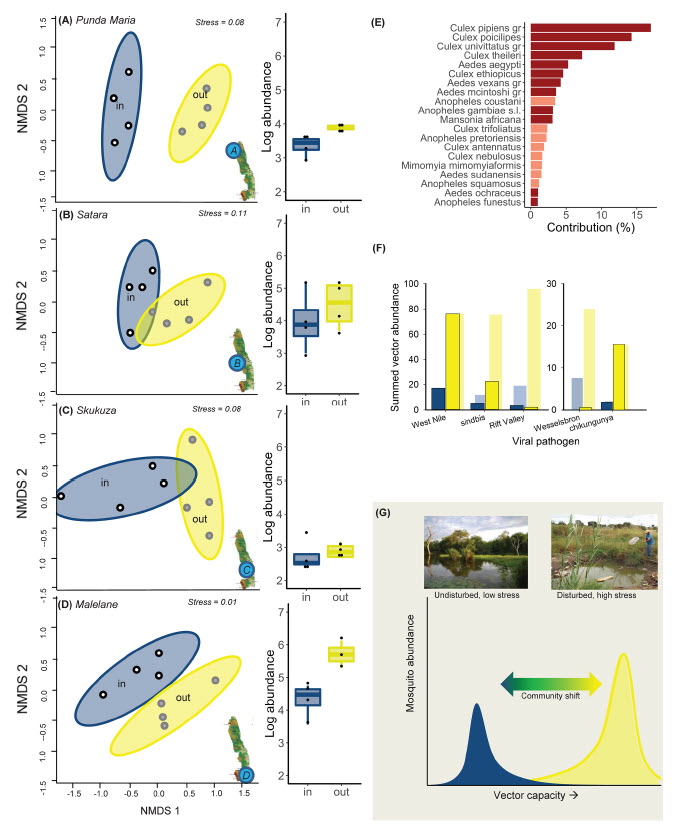
Efectos del cambio de uso de la tierra inducido por el hombre sobre la composición y abundancia de mosquitos. (A – D): NMDS y diagramas de caja que muestran cambios en la composición y abundancia entre sitios dentro ("dentro") y fuera de KNP ("fuera"). Los puntos más alejados son más diferentes; los círculos representan intervalos de confianza del 95%; los valores de tensión representan bondad de ajuste. (E) SIMPER mostrando la contribución relativa de las especies a los cambios en la composición de especies entre sitios dentro y fuera de KNP. Solo se representan las especies que explican > 1% de la variación. Barras de color rojo oscuro: vectores de enfermedades conocidas; barras de color rojo claro: no vectores 32. (F) Abundancia sumada de vectores primarios (barras delineadas con colores saturados) y secundarios32 (barras con tonos claros y sin contorno) (G) Diagrama conceptual que sintetiza cómo los factores de estrés antropogénicos pueden impulsar la capacidad del vector al cambiar las comunidades de especies de mosquitos de los de bajo ) hacia condiciones de alto estrés (amarillo).
Juntos, estos resultados muestran que las perturbaciones humanas están fuertemente asociadas con una mayor abundancia de mosquitos y cambios en la composición de la comunidad hacia vectores de enfermedades conocidas, como se ilustra en la Figura conceptual 2G. Destacan la importancia demostrada experimentalmente de los cambios en las condiciones ambientales 5, 6 al identificar su patrón constante en grandes extensiones geográficas y condiciones climáticas. Estos resultados enfatizan que las perturbaciones antropogénicas del paisaje y el entorno larvario representan un mecanismo importante que impulsa la distribución de los vectores. Dada la extensión e intensidad global de las presiones antropogénicas investigadas 1, estos resultados probablemente sean relevantes para una amplia gama de patógenos transmitidos por vectores y proporcionan un mecanismo para la asociación entre la degradación del ecosistema y las enfermedades 36, 37. Esto plantea cuestiones importantes sobre cómo las diferentes actividades humanas impulsan la prevalencia de vectores en las comunidades de mosquitos y presenta nuevas oportunidades para acciones preventivas específicas, así como modelos predictivos de los riesgos de enfermedades transmitidas por vectores en relación con los servicios de los ecosistemas.
Métodos
La captura e identificación de mosquitos se han descrito anteriormente 31; El muestreo de mosquitos se realizó en 4 regiones y 112 noches de captura, con recolecciones simultáneas durante 3 a 4 noches consecutivas en todos los puntos de muestreo de una región (4 dentro y 4 fuera de KNP). Los puntos de muestreo dentro de una región se seleccionaron según varios criterios. El criterio de selección principal fue tomar muestras de cuerpos de agua que fueran representativos de la región, incluida una diversidad de humedales en lugar de aquellos con las tasas de captura más altas 28. Los criterios adicionales estipulaban que los cuerpos de agua estaban separados por al menos 1 km entre sí para evitar muestrear mosquitos de cuerpos de agua adyacentes, ya que las distancias medias de dispersión de los mosquitos oscilan entre 35 ma 1,4 km 31. En esta configuración, seguimos el marco de los límites del ecosistema 38 y cuantificamos 5 presiones asociadas con los impactos humanos en los diferentes ecosistemas. La concentración de diferentes organofosforados persistentes (COP, por ejemplo, DDT y productos de degradación) se midió en 2 puntos de muestreo por región utilizando un análisis de residuos múltiples (GC-ECD y GC-MS) por el African Research Council (Roodeplaat, Sudáfrica). Determinamos los niveles de fosfato (PO43−) utilizando un fotoespectrómetro (Merck Spectroquant Nova 60) en un litro de agua, que estaba compuesto por 20 submuestras de 50 ml por punto de muestreo. La fracción de área desnuda y con vegetación escasa en cada punto de muestreo se evaluó utilizando datos satelitales derivados del sensor Sentinel-2 adquirido en enero de 2017. El índice de vegetación mejorado de 2 bandas (EVI) 39 se calculó a partir de un compuesto EVI máximo mensual evitando disturbios. Para derivar el porcentaje de áreas estériles y con poca vegetación, se utilizaron umbrales de EVI de 0,15 y 0,35, respectivamente.
La proporción de píxeles estériles y con poca vegetación (10 * 10 m) dentro de un radio de 150 m alrededor de cada punto de muestreo se tomó como una muestra representativa de la cubierta vegetal para cada una de las ubicaciones de captura. La fracción de área desnuda y con poca vegetación se evaluó utilizando el Índice de Vegetación Mejorada máximo mensual (EVI; utilizando Sentinel-2data de enero a marzo de 2017). En un radio de 150 m alrededor de cada punto de muestra, estimamos el porcentaje de píxeles (10 * 10 m) entre los umbrales de EVI de 0,15 y 0,35, respectivamente. Las densidades de animales en cada punto de muestreo se determinaron utilizando el ganado cuadriculado del mapa mundial (fao.org/livestock-systems/global-distributions; resolución: 0.05 ′ * 0.05 ′ grados ~ 5 * 5 km) y el búfalo africano KNP 2018 (Syncerus caffer) cuenta. Todos los números se transfirieron a un archivo ráster con celdas de cuadrícula de 0.05 ′ * 0.05 ′, después de lo cual se calculó la densidad promedio en un anillo de amortiguación de 2 km de diámetro alrededor de cada punto de muestreo. Las densidades de población humana para cada una de las regiones dentro y fuera de KNP se determinaron utilizando el censo de población de 2011 utilizando datos a escala del municipio (https://www.statssa.gov.za).
Para probar las diferencias en la abundancia de mosquitos dentro y fuera de KNP, utilizamos modelos lineales generales que comparan el número de mosquitos recolectados en cada sitio agregado durante cada noche. Se incluyeron como efectos principales la región (Punda Maria, Satara, Skukuza y Malelane), la perturbación (dentro vs. fuera de KNP) y su interacción. El número de mosquitos recolectados se dispersó en exceso, se transformó logarítmicamente para la normalidad y se evaluó mediante gráficos de cuantiles y una prueba de Levene (P = 0,06). Los supuestos de independencia del modelo de regresión se evaluaron utilizando gráficos de los residuos del modelo por ubicación y distancia entre sitios.
Las diferencias en la composición de la comunidad dentro y fuera de KNP se probaron con base en los datos de composición de especies agregados a lo largo de todas las noches en cada sitio, porque se necesitan múltiples noches de captura para capturar especies raras 26, 31. Los datos se analizaron mediante un análisis no paramétrico de análisis de similitudes (ANOSIM) y se visualizaron con escala multidimensional no métrica (NMDS). El análisis ANOSIM es una prueba no paramétrica para las diferencias en las comunidades de mosquitos entre las trampas que compara los rangos de las medidas de disimilitud de Bray-Curtis de las muestras recolectadas dentro y fuera de KNP 40, 41. Se utilizó un análisis SIMPER para evaluar qué taxones son responsables de los cambios en la composición de la comunidad 42. También se informan patrones generales de riqueza y diversidad (J de Shannon, H'max de Shannon y uniformidad de Simpson) (Fig. S2A-C), pero el análisis SIMPER proporciona que es más apropiado, porque se desarrolló para identificar las especies responsables de los cambios en medidas comunitarias 42. Todos los análisis se realizaron en R utilizando los paquetes lme 4 y vegan 43, 44.
Fuente: https://www.nature.com/